今天小编要和大家分享的是原电池反应原电池的组成,接下来我将从原电池的组成,这几个方面来介绍。
将化学能转变为电能的装置称为原电池。
原电池的组成
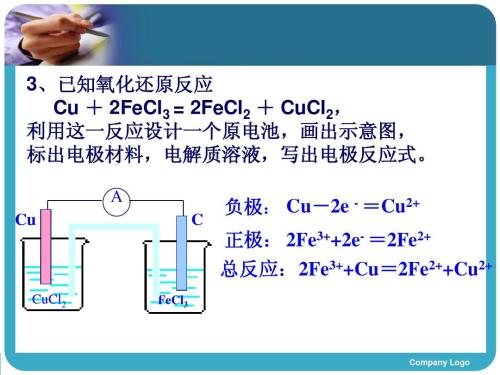
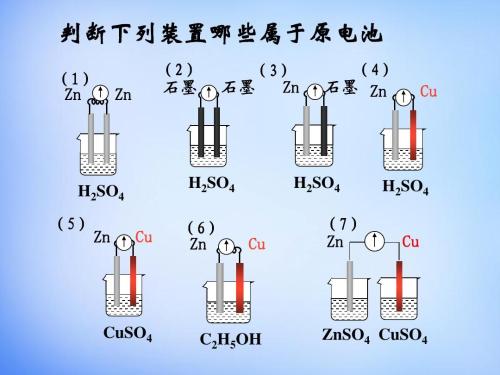
组成原电池有四个不可缺少的条件(极、电、路、自发):
两种活泼性不同的金属(或另一种为非金属导体)构成电极。
电解质溶液
形成闭合回路
氧化还原反应能自发进行(至少有一个电极与电解质溶液反应)
当把锌板和铜板平行放入盛有稀硫酸的烧杯里,用连有电流计的导线连接两极时,可以观察到三个重要的现象:锌片溶解,铜片上有气体逸出,导线中有电流通过。
此外,在食盐溶液加快生锈的过程中,也发生了原电池反应
透过这些现象,分析两极反应的实质,便可理解原电池是怎样把化学能转变为电能的原理。锌是活泼金属,容易失去电子变为锌离子。锌电极发生的电极反应式是:
锌片Zn-2e-=Zn2+(氧化反应)
锌离子进入溶液,使得溶液里的正电荷过多;同时锌失去的电子沿导线经电流计流入铜片,使溶液里原有的氢离子在铜电极上被还原成氢原子,这样溶液中多余的正电荷就被中和;氢原子又结合成氢分子并放出。铜电极发生的电极反应式是:
铜片2H++2e-=H2↑(还原反应)
由于在锌、铜两个电极上不断发生的氧化还原反应,使化学能转变为电能。锌片是给出电子的一极,是电池的负极,铜片是电子流入的一极,是电池的正极。电流的方向同电子流的方向相反,从正极铜流向负极锌。
在原电池内电解质溶液中,阴离子流向负极,阳离子流向正极
关于原电池反应,电子元器件资料就介绍完了,您有什么想法可以联系小编。